Материал проверен врачами клиники. 2024 г.
Содержание
- Консультация
- Вступление
- Теория выживания жира
- Теория замещения клеток
- Жизнеспособность пересаженной ткани
- Теория замещения жира
- Теория выживания и теория замещения
- Последовательность процессов в тканях после пересадки жира
- Врачи
Жир при липофилинге или судьба жирового трансплантата после его свободной пересадки
(Левицкая М.Г.)
Мы живем в эру липофилинга. Хотя первые шаги в пересадке жировой ткани сделаны свыше 100 лет тому назад, активно развиваться направление стало только в последнее десятилетие. Это связано с тем, что многие годы липофилинг расценивался, как неконтролируемая процедура с непредсказуемым результатом, а вследствие несовершенства техники большая часть жира рассасывалась после пересадки. И это в лучшем случае. А в худшем — отмечались осложнения в виде уплотнений, формирования кист, кальцинатов и прочие.
По этим причинам Американским обществом пластических хирургов на долгие 20 лет (в период с 1987 по 2007 годы) был запрещен липофилинг молочных желез. Но благодаря усилиям верных приверженцев и ученых, таких как S. Colеman, R. Кhouri, K. Yoshimura и др., сегодня свободная трансплантация жира переживает новый виток развития. И какой! Ведь только в начале 21 века ученые открыли стволовые клетки в жировой ткани! А сколько еще впереди открытий, связанных с липофилингом?!
Пересадка жировой ткани пользуется все большим успехом как среди пластических и реконструктивных хирургов, так и среди пациентов. Отношение к липофилингу диаметрально противоположное: от резко отрицательного, до восторженного, ясно одно — равнодушных нет. По данным статистики только за последний год количество трансплантаций собственной жировой ткани (как изолированного липофилинга, так и в сочетании с другими операциями) увеличилось на 19%!
На каждом современном конгрессе огромное количество времени отводится для докладов по липофилингу. И это понятно — область применения свободной пересадки жировой ткани безгранична: омоложение и бьютификация лица, увеличение груди, увеличение ягодиц, липофилинг голеней, лечение рубцов и язв, устранение деформаций и заполнение дефектов мягких тканей, реконструкция молочных желез после резекции или мастэктомии, коррекция осложнений после эндопротезирования и многое другое. Удивительно, но липофилинг уверенно конкурирует с силиконовыми имплантатами.
Доклады сопровождаются бурными дискуссиями. Вызывают живой интерес и активно обсуждаются техника забора жира, способы его подготовки к пересадке, результаты, статистика и процент приживления. Вопросов множество: как и каким образом происходит процесс приживления? Сколько времени необходимо для его завершения? Почему у одних пациентов (при одинаковых исходных данных — хирург, инструменты, методика, одинаковый объем пересадки и т.д.) мы наблюдаем приживаемость 80%, у кого-то — 100%, а у некоторых только 50%?
Почему при мегапересадке жира (1 литр в каждую ягодицу, 450 мл в каждую грудь и т.д.) мы получаем не дряблое целлюлитное «нечто», а красивые формы с упругой и гладкой поверхностью? Почему область, в которую пересажена жировая ткань, омолаживается? Ведь эффект омоложения тканей после липофилинга постепенно нарастает, и через 3-4 месяца после операции пациенты выглядят лучше, чем через 1 месяц? Почему помимо увеличения объема улучшается цвет и тургор кожи, уходит пигментация? Кожа становится сияющей, наполненной, ухоженной как в юности?
Почему жир не мигрирует? Но главными вопросами, беспокоящими не только хирургов, но и пациентов, остается судьба жира после его свободной трансплантации. Каков механизм, обеспечивающий выживание жировых трансплантатов? И что происходит в тканях после пересадки жировых клеток?
Теория выживания жира при липофилинге
Сейчас общепринятой является теория выживания жирового трансплантата, впервые предложенная Lindon Peer в начале 50-х годов прошлого столетия. Он оказался первым, кого заинтересовала судьба пересаженного жира. Основываясь на исследованиях, L. Peer предположил, что аутологичный жировой трансплантат выживает после пересадки, сохраняя свойства жировой ткани и теряя при этом в среднем около 45% своей первоначальной массы и объема в течение года после трансплантации.
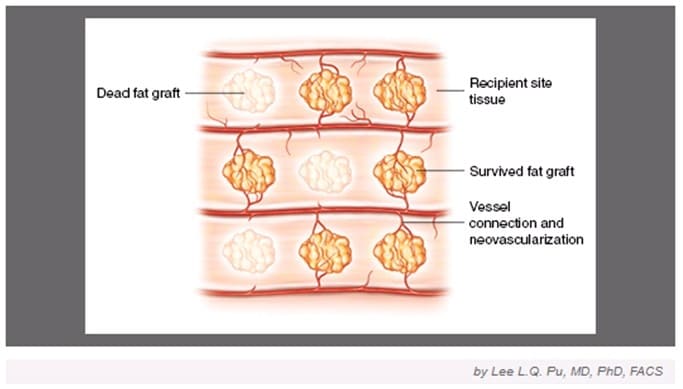
Выживают те клетки жирового трансплантата, которые сразу получают достаточное кровоснабжение, в то время как остальная часть разрушается и постепенно выводится из организма. По данной теории механизм выживания жирового трансплантата основан на скорейшем восстановлении кровоснабжения благодаря созданию сосудистых анастомозов (естественное соединение, соустье между 2 капиллярами) между жировым трансплантатом и кровеносными сосудами реципиентной (принимающей) зоны (рис.1).
|
|
Теория выживания жира при липофилинге. После фетграфтинга выживают только те графты, которые получают кровоснабжение из реципиентной зоны |
| Рис.1. Из статьи «Current Theory on Fat Graft Survival After In Vivo Transplantation» (Lee L.Q. Pu, MD, PhD, FACS). |
Исходя из теории выживания жировых клеток, на протяжении многих лет совершенствовалась методика забора жировой ткани, подготовка ее для пересадки и способы введения. Для успешной пересадки необходимо максимально сохранить жизнеспособность жировых клеток. Поэтому забор жира при липофилинге выполняется с помощью атравматичной техники: под постоянным, контролируемым низким давлением, небольшими по диаметру канюлями с множеством отверстий на конце.
Обязательно соблюдается принцип минимального по времени контакта жировой ткани с воздухом (для уменьшения вероятности окислительных процессов). В процессе подготовки жира к пересадке удаляется масло, излишки промывной жидкости и примеси крови, чтобы полученный жировой трансплантат был относительно компактный и унифицированный.
В своем исследовании Carpaneda и Ribeiro пришли к выводу, что выживает только часть жирового графта (небольшого фрагмента), которая располагается в пределах 2 мм от васкуляризированной (богатой сосудами) реципипентной ткани, благодаря плазматической диффузии (пропитыванию жидкой частью крови).
Методика пересадки жировой ткани должна обеспечивать максимальный контакт каждой микроскопической «капли» жира с тканями реципиентной (принимающей) зоны для более быстрого восстановления кровоснабжения. Инъекции должны быть атравматичными: жир при липофилинге необходимо вводить небольшими порциями, на обратном ходу канюли, несколькими проходами, создавая множество туннелей в разных плоскостях.
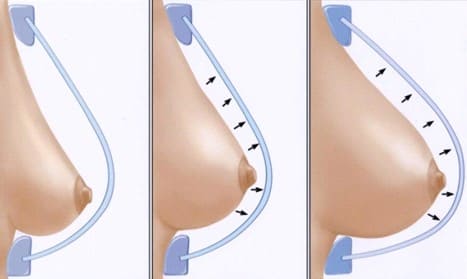
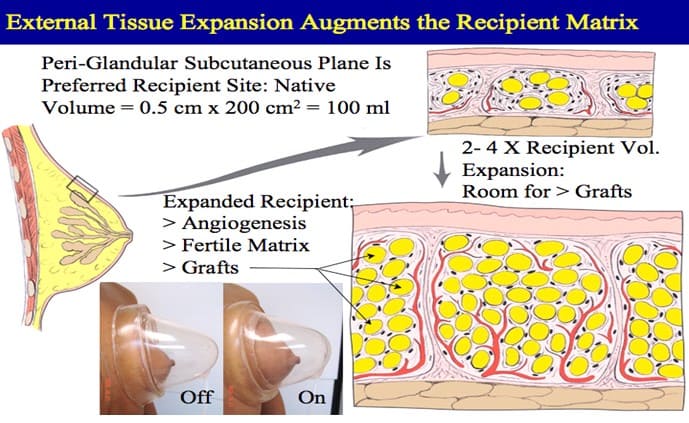
Важный вклад в развитие липофилинга и теорию выживания жира внес Roger K. Khouri, предложивший сочетать свободную пересадку жировой ткани в область молочных желез с предварительным использованием наружной экспансии тканей груди с помощью вакуумной системы «BRAVA» (рис.2).
обеспечиваются условия ее лучшего приживления (рис.3,4).
На схемах автор демонстрирует, каким образом наружная экспансия тканей молочных желез приводит к увеличению площади реципиентной зоны, неоангиогенезу (прорастанию и увеличению количества новых сосудов). Все это создает возможность для пересадки большего количества жировой ткани одномоментно, а также улучшает выживание клеток жирового трансплантата.
Совсем недавно, Zhao et al from China опубликовали данные исследований на животных, подтвердившие теорию выживания жировых клеток. Авторы вводили в спинки мышей жировые трансплантаты (графты), объемом около 0,2 мл. Образцы жира были получены из каждого животного на 3-й день, 7-й день, 2 недели, 4 недели, 2 месяца, и 4 месяца после трансплантации. Оценка образцов производилась по объему трансплантата, гистологии и тканевому происхождению, особое внимание уделено происхождению и плотности новообразованных сосудов.
Авторы обнаружили, что некоторые жировые трансплантаты выжили после пересадки: они имели уникальные характеристики, которые их гистологически идентифицировали как донорские (пересаженные), а не реципиентные. Исследование также определило, что новообразованные сосуды проросли в жировые графты из реципиентных тканей. При этом плотность капилляров была одинакова в обеих зонах.
Гистологическая оценка показала различные этапы выживания жирового трансплантата после пересадки: воспаления, неоваскуляризации, ремоделирования и зрелости. Авторами убедительно доказано, что пересаженные жировые трансплантаты выживают после реваскуляризации в реципиентной зоне (рис.1).
Теория замещения клеток в жировом трансплантате
Suga et al from the University of Tokyo оспаривают теорию выживания жировых клеток после свободной пересадки и выдвигают теорию замещения клеток в жировом трансплантате.
Они провели эксперимент: создали хирургически индуцированную модель ишемии путем разделения кровеносных сосудов, снабжающих паховые жировые отложения у мышей. С помощью модели на животных авторы исследовали выживаемость адипоцитов в условиях гипоксии в естественных условиях (in vivo) и пробирке (in vitro) в режимах 3 различных степеней ишемии (легкая, средней тяжести и тяжелая).
Эксперимент показал, что каждый тип клеток имеет различную толерантность (устойчивость) к ишемическому (нарушение кровоснабжения) стрессу, а стволовые клетки жировой ткани более устойчивы к гипоксическим состояниям (резкое снижение или отсутствие кислорода) по сравнению с эндотелиальными и гемопоэтическими клетками.
Анализ показал, что адипоциты погибают в 1-1 день ишемии, эндотелиальные клетки на 2-1, а стромальные клетки жировой ткани погибают только на 3-й день. Результаты эксперимента, проведенного в пробирке (in vitro), по мнению авторов, опровергают теорию клеточного выживания; по их мнению, большая часть адипоцитов в неваскуляризированном жировом трансплантате вряд ли выживет даже при условии помещения трансплантата в хорошую реципиентную зону.
Известный факт, что неваскуляризированные жировые трансплантаты получают питательные вещества и кислород благодаря плазматической диффузии из окружающих тканей до прорастания и повторного подключения капилляров и сосудов.
Авторы пришли к выводу, что в ранее проведенных исследованиях определяли жизнеспособность жировых клеток только по их морфологии, используя стандартные красители, такие как гематоксилин и эозин. Подобная окраска гистологических срезов не позволяет отличить живых адипоцитов от погибших, а мертвый адипоцит (круглая липидная клетка) легко принять за живой. Важно и то, что адипоциты имеют большой размер (от 50 до 150 мкм в диаметре).
Для справки: 1 микрометр, он же микрон, (1мкм) = 0,001 мм или 10-3 мм = 0,0001см или 10-4 см =0,000001м или 10-6м. При подготовке препарата один адипоцит разрезают на множество гистологических срезов (с регулярной толщиной от 3 до 10 мкм). Так он попадает в несколько препаратов, следовательно, при подсчете количество жировых клеток будет явно превышено. Таким образом, нельзя подтвердить жизнеспособность адипоцитов по форме или присутствию ядра.
Ученые из Токайского университета для определения жизнеспособности адипоцитов используют иммуноокрашивание perilipin-белком, покрывающим липидные капли только в живых адипоцитах. К тому времени было доказано, что мертвые адипоциты perilipin-белком не окрашиваются, т.е. являются негативными для perilipin.
В ранее проведенном исследовании, человеческая жировая ткань пересаживалась в спины мышей. Гистологическая картина характеризовалась формированием 3 зон в период с 3 по 4 неделю после пересадки: периферическая (представлена жизнеспособными адипоцитами), промежуточная (воспалительные процессы), и центральная (зона некроза).
Исследование определило жизнеспособность трансплантата на основе морфологии (гистологического строения) адипоцитов и привело к выводу, что жизнеспособной является область трансплантата примерно 1,5 на 0,5 мм от края, а 60% адипоцитов в жизнеспособной зоне погибает. В других исследованиях анализ жизнеспособности клеток и апоптоза(программируемой клеточной гибели) проводили всей жировой ткани, и специальная оценка адипоцитов не производилась.
В последнем эксперименте авторы тщательно оценивали жизнеспособность адипоцитов по интенсивности окрашивания, потому что только спустя несколько дней после смерти жировая клетка полностью теряет perilipin окрашивание. Адипоциты, которые слабо окрашивались perilipin-белком, возможно, уже погибли в момент пересадки или первые дни после нее (они называются умирающими адипоцитами в данном исследовании), т.к. все подобные клетки полностью потеряли perilipin окрашивание на более позднем этапе, как видно на гистологии, выполненной на 5-й день.
- Жизнеспособная зона, в которой адипоциты выжили;
- Зона регенерации. В ней адипоциты погибли, но стромальные клетки жировой ткани выжили, а мертвые адипоциты замещены новыми;
- Зона некроза, в которой погибли адипоциты и стромальные клетки жировой ткани.
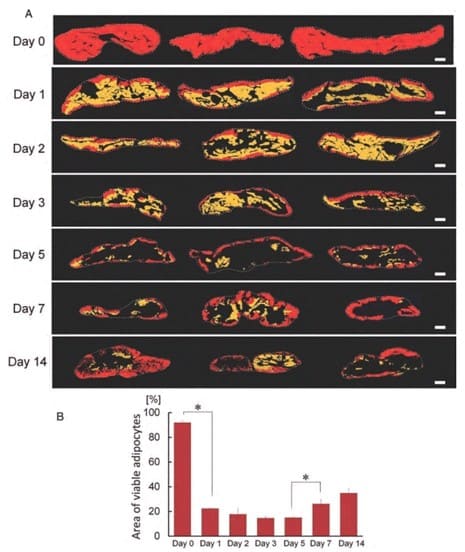
Жизнеспособность пересаженной жировой ткани
В каждой строчке 3 образца, полученные от 3 разных мышей.
- Зона, заполненная жизнеспособными адипоцитами (область резко положительная для perilipin-белка), окрашена в красный цвет.
- Зона, наполненная умирающими адипоцитами (слабо положительная для perilipin-белка область), обозначена желтым цветом.
- Зона мертвых адипоцитов или соединительной ткани (Отрицательная для perilipin-белка область) показана черным цветом.
Красная область резко сократилось на 1 день, а желтая практически исчезла к 5 дню. Установлено, что только некоторые адипоциты, расположенные менее чем в 300 мкм от поверхности ткани, остались живы, а все остальные погибли в течение нескольких дней после пересадки.
Выжили только адипоциты, которые располагались по периферии, а глубина жизнеспособной зоны составляет примерно в 300 мкм от края трансплантата: почти все жировые клетки, расположенные глубже 300 мкм, погибли в течение нескольких дней после пересадки. Это означает, что выявлено значительно меньше выживших клеток по сравнению с предыдущими сообщениями, в которых для оценки использовали стандартную гистологию.
Со 2 по 5 день, изменений в жизнеспособной зоне не наблюдалось, однако зона умирающих адипоцитов (жировые клетки с слабо положительной реакцией на perilipin окрашивание) уменьшалась в размерах изо дня в день. Иммуногистология на 5 день показала процент выживших адипоцитов в трансплантатах, хотя теоретически коэффициент выживаемости должен меняться в зависимости от размера трансплантата и условий окружающих тканей (например, васкуляризация).
Интересен факт, что толщина жизнеспособной зоны, прилежащей к коже больше, чем ее толщина со стороны, прилежащей к костям. Вероятнее всего, это было связано с лучшим кровоснабжением контактных тканей со стороны кожи.
Число размножающихся (пролиферирующих) клеток увеличилось с 3-го дня, а жизнеспособная область адипоцитов начала расти в размерах с 7-го дня, свидетельствуя о регенеративных изменениях, направленных на восстановление тканей.
С 5 дня во внутренней пограничной зоне жизнеспособной области наблюдались небольшие (50 мкм в диаметре) «новорожденные» адипоциты, сильно окрашиваемые perilipin индикацией. Это говорит о том, что стволовых клетки или клетки-предшественники (они же стромальные клетки жировой ткани) не погибли. По крайней мере, в периферической части трансплантата началось восстановление ткани адипогенезом (созданием пула «новорожденных» жировых клеток — «нового поколения» адипоцитов) и ангиогенезом (созданием новых сосудов). Исследования в пробирке (in vitro), указывающие на сильную устойчивость стромальных клеток жировой ткани к тяжелой ишемии, поддерживают эту идею.
Таким образом, гибель только адипоцитов не означает некроз (омертвение) жировой ткани, а вызывает каскад регенерации, восстановления. В отличие от этого, гибель адипоцитов и клеток-предшественников (стромальных клеток жировой ткани), теоретически приводит к некрозу жировой ткани.
Элементы соединительной ткани сохраняются в качестве каркаса, но все дифференцированные клетки, расположенные глубже, чем 300 мкм от поверхности трансплантата, погибают. Они замещаются клетками следующего поколения благодаря активности тканеспецифичных стволовых клеток/клеток-предшественников, в зависимости от микроокружения или микросреды.
Стволовые клетки не только выживают при ишемии легкой, средней и тяжелой степени, но и активируются, способствуя регенерации поврежденной ткани. Авторы предложили, теорию замещения, по которой обогащение фэтграфтинга стволовыми или клетками-предшественниками увеличивает и ускоряет процесс восстановления жировой ткани при ишемии. Исследование продемонстрировало убедительное свидетельство динамичного ремоделирования жировой ткани после фэтграфтинга.
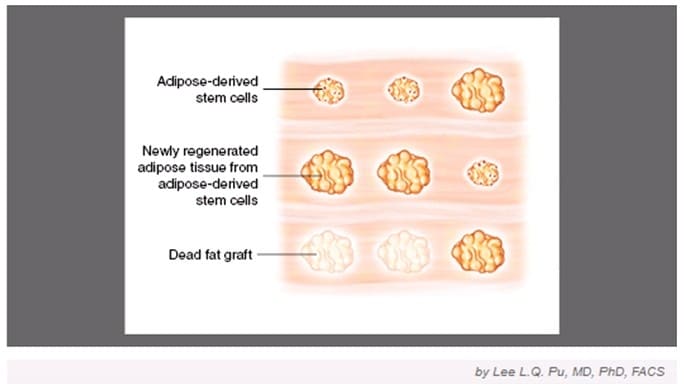
|
Рис.6. Из статьи «Current Theory on Fat Graft Survival After In Vivo Transplantation» (Lee L.Q. Pu, MD, PhD, FACS). |
Теория замещения жира при липофилинге
После трансплантации жира большинство графтов погибает вследствие ишемии. Однако стволовые клетки жировой ткани выживают, т.к. устойчивы к ишемии легкой и средней степени, и дифференцируются в адипоциты в реципиентной зоне. Все жировые графты выживают в основном благодаря регенерации из стволовых клеток.
Однако расстояние плазматической диффузии строго ограничено градиентом кислорода и питательных веществ, поэтому регенерация, как правило, не полная, что приводит к значительной атрофии и/или дисфункции ткани неваскуляризированных трансплантатов.
Обе теории — замещения жира при липофилинге и выживания трансплантата составляют современное представление о судьбе жировых трансплантатов в естественных условиях после пересадки (рис.7).
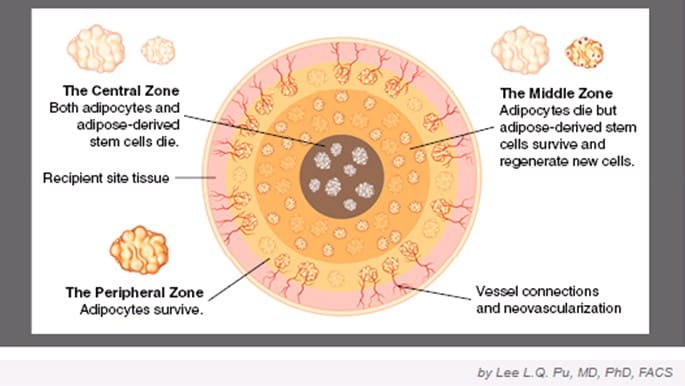
|
Рис.7. Из статьи «Current Theory on Fat Graft Survival After In Vivo Transplantation» (Lee L.Q. Pu, MD, PhD, FACS). |
Комбинация теории выживания и замещения помогает понять механизм выживания жирового трансплантата после пересадки.
В самой поверхностной, периферической зоне, выживание жировых графтов в большей степени объясняется теорией выживания. "Зона выживания", имеет толщину менее чем 300 мкм. В ней сохраняются адипоциты и стромальные стволовые клетки жировой ткани (ASCs).
В средней зоне выживание жировых графтов базируется на теории замещения. "Зона регенерации", толщина которой варьирует в зависимости от условий микроокружения, таких как кровоснабжение и принадлежность к окружающим тканям. В этой зоне адипоциты умирают уже в 1 день, а стволовые стромальные клетки жировой ткани выживают и дают начало новым адипоцитам, которые заменяют мертвые.
Расположенная в самом центре зона — это "зона некроза", в которой адипоциты и стромальные стволовые клетки жировой ткани умирают, регенерация не происходит, а мертвое пространство будет заполнено рубцовой тканью.
Теория выживания и теория замещения
Последовательность процессов и фаз, происходящих в тканях после фэтграфтинга в естественных условиях (in vivo) Yoshimura др. резюмировали послеоперационную последовательность процессов, происходящих в тканях после фэтграфтинга:
1. Адипоциты, расположенные в пределах 300 мкм от поверхности ткани, выживают.
2. Жировые клетки, расположенные глубже 300 мкм от поверхности графта, погибают в течение первых нескольких дней после трансплантации. Активированные стволовые клетки жировой ткани и клетки-предшественники начинают адипогенез и ангиогенез, в результате которого часть мертвых адипоцитов заменяется новыми жировыми клетками следующего поколения в течение первых 3 месяцев.
Мертвые адипоциты (липидные или жировые капли) поглощаются в течение последующих 9 месяцев. Липидные капли медленно поглощаются макрофагами путем фагоцитоза (активный захват, поглощение и переваривание) и период абсорбции (рассасывания остатков погибших клеток) зависит от диаметра капелек липидов.
Чем меньше размер капелек, тем быстрее происходит этот процесс и наоборот. Жировые капли большого диаметра постепенно отграничиваются от окружающих тканей рубцовой тканью, с формированием кист, стенки которых с течением времени могут обызвестляться (кальцинироваться, уплотнятся за счет отложения в них кальция). Происходит отложение солей кальция в рубцовых тканях.
3. В центральной части трансплантата гибнут не только адипоциты, но и стволовые клетки жировой ткани, а на их месте образуются кисты или рубцовая ткань.
4. Асептическое воспаление, протекающее в мягких тканях после трансплантации жира, приводит к формированию рубцовой ткани между кожей и глубже лежащими тканями. Новые рубцовые спайки формируют плотный ячеистый каркас, похожий на соты, ячейки которых заполнены клетками жировой ткани.
5. Окончание задержки жидкости после фэтграфтинга (отечного синдрома) определяется скоростью успешной замены погибших адипоцитов. Если пересаженная жировая ткань имеет лишь небольшие липидные капли, поглощение завершается к концу 3-го месяца. Объем пересаженной и прижившейся жировой ткани затем существенно не изменится, результат будет стабильным.
Если остается много крупных липидных капель спустя 3 месяца, жировая ткань будет атрофироваться (уменьшаться в объеме) до 12 месяцев.
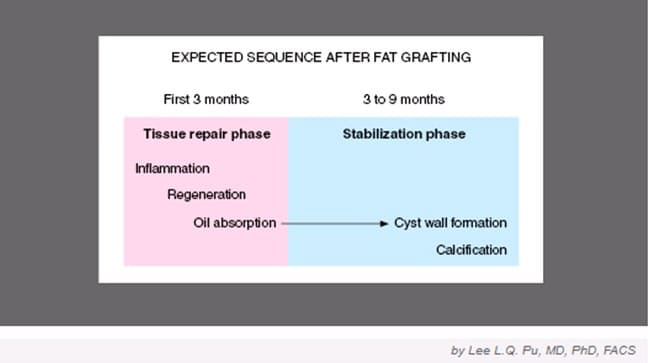
Послеоперационную последовательность после фэтграфтинга иллюстрирует (рис.8).
Рис.8. Из статьи «Current Theory on Fat Graft Survival After In Vivo Transplantation» (Lee L.Q. Pu, MD, PhD, FACS).
Последовательность процессов в тканях после пересадки жировой ткани
В регенераторной фазе, проходящей в течение первых 3 месяцев: воспаление, регенерация и поглощение масла в реципиентной зоне.
На этапе стабилизации длительностью от 3 до 9 месяцев, происходит капсуляция масла и формирование кист, которые полностью поглощаются или обызвестляются со временем в реципиентной зоне.
В заключение хочется сказать, что теория выживания и теория замещения прекрасно дополняют друг друга. Можно предположить, что у одних пациентов большее значение имеет способность пересаженных адипоцитов к выживанию, а у других к замещению — ремоделированию жировой ткани за счет активации стволовых клеток.
Обе теории важны и необходимы для понимания механизма приживления жировой ткани, а также процессов, происходящих в тканях после выполнения фэтграфтинга, что важно врачам и пациентам.
Хирургам это понимание необходимо, чтобы бережнее обращаться с жировой тканью и использовать атравматичные техники для забора, подготовки жира, оттачивая свое мастерство и методику для максимального сохранения жизнеспособности адипоцитов внутри жировых трансплантатов.
Технику инъекций важно улучшать так, чтобы пересаженные жировые клетки имели максимальный контакт с тканями реципиентной зоны для скорейшего восстановления кровоснабжения. Также нужно помнить о «возможностях» реципиентной зоны и использовать технологии для улучшения кровообращения в ней.
Пациентам эта информация важна для успокоения, окончательного осознания, что липофилинг не миф, а реальность. Фэтграфтинг эффективен и позволяет создавать яркие, прекрасные и стабильные результаты.
Самое главное: Липофилинг — это не просто способ наполнения мягких тканей и создания объема. Свободную трансплантацию жировой ткани следует рассматривать, как регенеративную, клеточную терапию.
Если всерьез рассматривать липофилинг как регенеративную технологию, становится понятно, каким образом происходит заживление лучевых язв, деформирующих рубцов, восстановление голосовых связок при афонии и многое другое. Теория замещения объясняет тот факт, что наилучшим образом результаты после липофилинга выглядят спустя 3 месяца, при этом объем прижившегося жира может быть существенно больше, чем через 1 месяц после операции.
Очевидно, что нам не «кажется», когда мы наблюдаем омоложение кожи и окружающих тканей в областях пересадки жировой ткани. Ясно, отчего после пересадки жировой ткани заживают хронические язвы, грубые рубцы становятся мягкими и незаметными, излечивается поврежденная облучением кожа. Можно без преувеличения сказать, что жировая ткань — заложенный в нас самой природой источник молодости и красоты, нужно лишь научиться ее «правильно готовить»!
Если у Вас еще остались вопросы после прочтения статьи о жире при липофилинге, звоните и записывайтесь на консультацию по телефону.
Клиника «Абриелль»г. Санкт-Петербург, Средний проспект В.О, д. 85Телефон: +7 (981) 187-87-87Мы работаем ежедневно с 09:00 до 21:00